DEBIT CARDIAQUE
NON INVASIF :
Doppler Oesophagien et autres modalités.
Dr Anne-Pascale FORGET

Service
des Urgences. Hal Salengro. CHRU Lille, 59037 LILLE Cedex.
e-mail : apforget@chru-lille.fr
| Titre |
DEBIT CARDIAQUE
NON INVASIF : |
| Auteur |
Dr Anne-Pascale FORGET |
 |
Service
des Urgences. Hal Salengro. CHRU Lille, 59037 LILLE Cedex. |
La mesure du débit cardiaque (Qc) est souvent indispensable en anesthésie-réanimation. La pression artérielle (PA) et les autres paramètres mesurés en routine, constituent des mauvais indicateurs de défaillance hémodynamique (1-3). Au cours de la chirurgie à haut risque, Shoemaker et al. ont démontré que la diminution du Qc en per-opératoire était prédictive d’une évolution postopératoire péjorative alors que la PA n’était pas modifiée (4). Cette observation suggère qu’une réanimation per-opératoire guidée par la mesure du Qc peut améliorer l’évolution postopératoire. Enfin, dans les situations hémodynamiques difficiles, la mesure du Qc peut être nécessaire afin d’orienter la thérapeutique et de surveiller son efficacité : administration d’un remplissage, de drogues inotropes ou vasoconstrictrices….
L’utilisation du cathéter de Swan-Ganz a été pendant de nombreuses années la seule méthode fiable de mesure du Qc malgré les nombreux pièges susceptibles d’altérer la précision des mesures obtenues. Son caractère invasif et la réévaluation récente de son rapport bénéfice-risque ont considérablement limité ses indications (5). Le développement de nouvelles techniques rapides, faciles, pas ou peu invasives a ainsi été encouragé.
Techniques de mesure non-invasive du Qc :
1. Doppler transoesophagien, transtrachéal et susternal :
La mesure non invasive ou semi-invasive de la vitesse d’écoulement du sang dans l’aorte thoracique ascendante ou descendante permet l’estimation du Qc.
Principes techniques de la mesure du Qc par effet Doppler: Les ultrasons sont des vibrations mécaniques comparables aux sons audibles mais de fréquence plus élevée. Dans un tissu immobile, la fréquence des ondes rétrodiffusées par les tissus est identique à celle des ondes incidentes émises par les cristaux piezo-électriques de la sonde Doppler. A l’opposé, lorsqu’une onde ultrasonore rencontre un diffuseur en mouvement, sa fréquence va être modifiée et les ondes rétrodiffusées vers la sonde auront une fréquence différente des ondes incidentes. La différence de fréquence mesurée permet le calcul de la vitesse de déplacement de la colonne sanguine en mouvement. La mesure du Qc par Doppler est obtenue par utilisation d’un Doppler continu : tous les écoulements rencontrés par le faisceau ultrasonore sur son trajet sont étudiés. Le positionnement d’une sonde Doppler à proximité de l’aorte permet l’insonation de l’aorte thoracique et le calcul de la vitesse moyenne d’écoulement du sang (Vmoy) dans celle-ci. Le débit aortique (QAo) pourra alors être obtenu selon la formule: QAo = Vmoy.(p D2 /4), où D est le diamètre aortique.
Les relations anatomiques étroites entre l’aorte thoracique descendante et l’œsophage (figure 1) ont permis le développement de la mesure du Qc par Doppler transoesophagien (DTO) (6) : la sonde Doppler est rapidement et facilement insérée et est descendue sur 35 à 40 cm dans l’œsophage. Le flux sanguin dans l’aorte thoracique descendante est aisément identifié sur le profil de vélocités affiché à l’écran et surtout sur les caractéristiques sonores typiques du flux aortique. L’obtention d’une mesure Doppler aortique ne prend habituellement que quelques minutes. La sonde peut alors être laissée en place et permet l’enregistrement en continu du flux sanguin aortique. Le déplacement secondaire de la sonde dans l’œsophage est fréquent : une simple rotation de la sonde est alors souvent suffisante pour récupérer une mesure fiable. Une formation minimale (moins de 12 examens) à cette technique permet d’améliorer la qualité des résultats obtenus (7). Deux types d’informations peuvent être apportées au clinicien grâce au DTO :
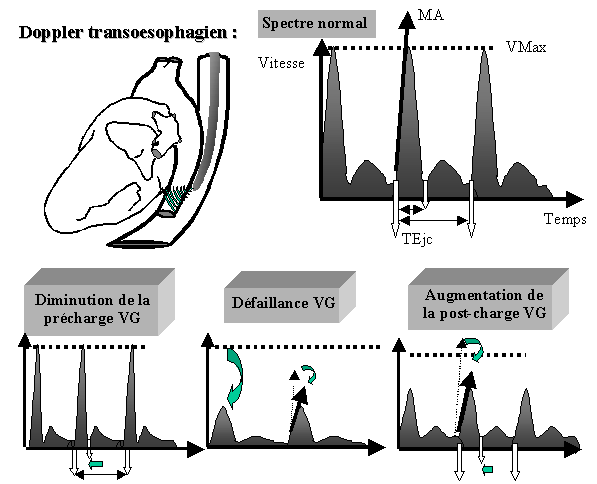
Figure 1 : Doppler transoesophagien.
Relations anatomiques entre l’œsophage et l’aorte thoracique descendante. La figure représente le spectre de vélocité aortique normale et ceux observés dans les principales insuffisances circulatoires. Une hypovolémie est caractérisée par un raccourcissement du temps d’éjection ventriculaire corrigé vis à vis de la durée du cycle cardiaque (TEjc). Une insuffisance ventriculaire gauche est caractérisée par une diminution de la vitesse maximale des érythrocytes dans l’aorte (Vmax) et par une diminution de l’accélération moyenne systolique (MA). Une augmentation de la post-charge est caractérisée par l’association des anomalies précédentes.
- Estimation du Qc : Le Qc peut être calculé à partir du DTO à 2 conditions : (i) la surface aortique doit être connue afin d’estimer le débit dans l’aorte thoracique descendante (QAo) à partir de la vélocité moyenne aortique (VAo). Elle est estimée soit par un capteur échographique placée dans la sonde œsophagienne (8) soit à partir de normogrammes intégrant l’âge, le poids et la taille. (ii) Le Qc est estimé à partir du QAo descendant en considérant que 30% du Qc est destiné aux troncs supra-aortiques. La corrélation entre le Qc mesuré par thermodilution et par DTO a été largement testée en anesthésie et en réanimation. La corrélation entre les mesures du Qc obtenues par thermodilution et par DTO est variable d’une étude à l’autre (8-12). Toutefois, les auteurs s’accordent à dire que la mesure du Qc par DTO a une fiabilité suffisante pour orienter la prise en charge thérapeutique et jugent le DTO comme un bon monitorage des variations du Qc au cours de l’évolution.
- la forme des courbes de vélocité (figure 1) permet l’évaluation de la fonction VG, du remplissage voire de la post-charge VG qui peuvent être évaluées à partir d’indices dérivés de la courbe Doppler aortique (13). Une diminution du temps utilisé au cours d’un cycle cardiaque pour l’éjection ventriculaire (temps d’éjection corrigé) suggère l’existence d’une hypovolémie. La vitesse maximale des érythrocytes et l’accélération de la colonne sanguine au début de la systole constituent des indices de la performance VG. Enfin, une diminution du temps d’éjection systolique associé à une diminution des indices de performance ventriculaire suggère une augmentation de la post-charge VG (13). Aussi, la simple visualisation du profil de vélocités aortiques et le calcul de paramètres mathématiques simples permet d’orienter les décisions thérapeutiques vers un remplissage vasculaire ou un traitement par inotrope. L’utilisation du DTO dans différentes circonstances chirurgicales telles que la chirurgie cardiaque ou pendant l’ostéosybthèse des fractures du col fémoral permet ainsi un meilleur contrôle de la volémie et améliore le pronostic post-opératoire (14,15). Les nombreux avantages du DTO (peu invasif, rapide, facile) rendent compte de son intérêt potentiel en anesthésie-réanimation.
D’autres abords Doppler de l’aorte thoracique ont été proposés : la mesure du débit dans l’aorte ascendante est possible par voie trans-trachéale grâce à l’utilisation de sondes d’intubation équipées, à leurs extrémités, d’un capteur Doppler. L’obligation d’utiliser des sondes d’intubation spécifiques, des difficultés techniques d’acquisition du signal et la corrélation parfois décevante des mesures obtenues avec le Qc limitent actuellement l’expansion de cette technique (16,17).
L’abord transcutané par voie sus-sternale permet la mesure de l’écoulement du sang dans la partie distale de la crosse aortique. Cette technique, non invasive, permet la mesure d’un débit suffisamment corrélé avec le Qc pour orienter la prise en charge thérapeutique d’un patient en état de choc (18,19). Les principales limites de cette technique sont l’impossibilité d’obtenir des mesures chez plus de 10% des patients et la nécessité d’une formation initiale de l’opérateur (18).
2. Impédancemétrie thoracique :
L’entrée et la sortie de sang dans le thorax à chaque systole provoque des modifications des propriétés électriques du thorax qui peuvent être mesurées par le calcul de l’impédance thoracique. Le volume de la cavité thoracique étant estimé à partir du poids, de la taille et du sexe du patient, l’impédance thoracique instantanée est calculée par application d’un courant électrique de faible amplitude et de haute fréquence entre deux paires d’électrodes l’une placée sur le cou et l’autre sur l’abdomen. Le traitement informatique des données obtenues pour chaque cycle permet l’estimation du Qc. Cette technique, élégante et non invasive se heurte toutefois à certaines difficultés techniques telles que l’acquisition du signal ou des défauts de validité de la modélisation informatique et géométrique du système. Aussi, les nombreuses études ayant comparé cette technique aux autres méthodes de mesure du Qc ont donné des résultats jugés suffisants mais variables d’une étude à l’autre (20), la qualité des mesures étant altérée chez les patients les plus sévères (21-24). L’utilisation de l’impédancemétrie thoracique en anesthésie a été rapportée et donne des résultats encourageants (25). Toutefois, le positionnement des électrodes et l’altération de la fiabilité des mesures après ouverture abdominale limitent l’intérêt de cette technique au cours de la chirurgie cervicale, thoracique voire abdominale (26).
3. Analyse de l’onde de pression artérielle (méthode du pulse contour) :
La mise en place d’un cathéter veineux profond et d’un cathéter artériel permet la mesure du Qc battement par battement selon la méthode du « pulse contour ». L’onde de PA est séparée en deux parties successives par l’incisure dicrote (figure 2). Une relation linéaire entre l’aire sous la courbe de la première partie systolique de l’onde de PA et le VES du VG a été démontrée. Aussi, les variations de cette surface (calculables à chaque battement cardiaque) permettent de prédire les variations du VES battement par battement (27). Parallèlement, le Qc est régulièrement mesuré selon une technique de thermodilution transpulmonaire méthodologiquement voisine de celle employée par les cathéters de Swan-Ganz. : les variations de température au niveau du cathéter fémoral après envoi d’un bolus froid dans le cathéter veineux central permettent le calcul du Qc. La mesure régulière de celui-ci permet l’étalonnage de la relation entre la surface sous la courbe de l’onde systolique de PA et le VES. Ainsi, la surveillance battement par battement de l’onde de PA permet le calcul battement par battement du VES et ainsi du Qc. Cette méthode a été validée en anesthésie cardiovasculaire (28), en réanimation (24,29,30) et chez l’enfant (31). Toutefois, d’importantes variations des résistances vasculaires systémiques altèrent la qualité des mesures et imposent des mesures fréquentes du Qc par thermodilution trans-pulmonaire (28,32 ). Certains appareils permettent, grâce à l’utilisation de la technique de dilution par deux indicateurs (l’un thermique et l’autre colorimétrique) la mesure du volume sanguin intra-thoracique et ainsi une estimation de la précharge cardiaque gauche fiable même chez les patients ventilés (33). En anesthésie, la réalisation d’études complémentaires est justifiée afin de préciser la fiabilité des mesures et l’intérêt de cette méthode restant invasive.
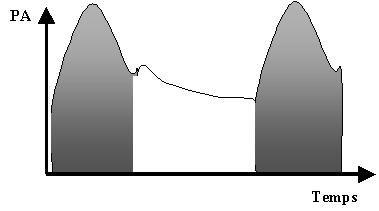
Figure 2 : Onde de pression artérielle.
L’aire sous la courbe de la première partie systolique de l’onde de pression artérielle (PA) est représentée en grisée.
Depuis une dizaine d’année, les appareils d’échographie cardiaque, bien qu’onéreux, deviennent disponibles dans les unités d’anesthésie-réanimation grâce au développement d’appareils polyvalents et mobiles. L’échographie cardiaque réalisée par voie transthoracique ou par voie transoesophagienne (ETO) apporte des informations morphologiques cardiaques exhaustives et hémodynamiques intéressantes en anesthésie : évaluation de la fonction VG, mesure de la taille des cavités, recherche d’anomalies valvulaires et péricardiques, visualisation d’un shunt intracardiaque, diagnostic des pathologies de l’aorte thoracique... L’intérêt de l’échocardiographie transthoracique (ETT) en anesthésie et en réanimation chirurgicale repose essentiellement sur son caractère non invasif. Si certains diagnostics sont alors facilement accessibles au prix d’une formation minimale de l’opérateur, l’évaluation du Qc et de la précharge ventriculaire gauche sont techniquement difficiles et ne doivent être réalisées que par des opérateurs expérimentés (34).
L’ETO permet le calcul fiable du Qc (35,36) : la mesure concomitante du flux sanguin au niveau d’une valve et de son diamètre permettent le calcul du volume d’éjection systolique et ainsi du Qc selon la formule : Qc = Vmoy.(p D2 /4). FC où FC est la fréquence cardiaque. Les mesures sont le plus souvent faites au niveau de la valve aortique mais peuvent aussi être réalisées au niveau de la valve mitrale et de l’artère pulmonaire (37). De plus, cette technique permet une évaluation fiable du remplissage grâce à la mesure de la surface télé-diastolique du ventricule gauche (38,39). Le principal inconvénient de cette technique semi-invasive est qu’elle doit être réalisée par un opérateur expérinenté et chevronné. La réalisation d’une ETO par l’anesthésiste n’est possible qu’au prix d’une formation rigoureuse et d’une pratique régulière.
De nombreuses techniques de monitorage hémodynamique moins invasives, moins coûteuses et plus rapides ont été développées ces dernières années en anesthésie-réanimation. Si l’expansion de ces différentes méthodes est certaine, chacune présente des particularités qui vont influencer leur indication. Pour exemple, la mesure pendant quelques heures du Qc chez un patient à haut risque d’hypovolémie sera au mieux réalisée par DTO alors que la mesure du Qc sur une plus longue durée orientera vers l’utilisation de l’impédancemétrie thoracique. Si toutes ces méthodes permettent la mesure du Qc, l’intérêt de chacune doit être discutée en fonction des besoins et des objectifs à atteindre pour chaque patient.
1. Mann C, Boccara G, Pouzeratte Y, Navarro F, Domergue J and Colson P. Hemodynamic monitoring using esophageal Doppler ultrasonography during laparoscopic cholecystectomy. Can J Anaesth 46: 15-20., 1999.
2. Shoemaker WC. Temporal physiologic patterns of shock and circulatory dysfunction based on early descriptions by invasive and noninvasive monitoring. New Horiz 4: 300-318., 1996.
3. Wo CC, Shoemaker WC, Appel PL, Bishop MH, Kram HB and Hardin E. Unreliability of blood pressure and heart rate to evaluate cardiac output in emergency resuscitation and critical illness. Crit Care Med 21: 218-223., 1993.
4. Shoemaker WC, Wo CC, Thangathurai D, Velmahos G, Belzberg H, Asensio JA and Demetriades D. Hemodynamic patterns of survivors and nonsurvivors during high risk elective surgical operations. World J Surg 23: 1264-1270., 1999.
5. Connors AF, Jr., Speroff T, Dawson NV, Thomas C, Harrell FE, Jr., Wagner D, Desbiens N, Goldman L, Wu AW, Califf RM, Fulkerson WJ, Jr., Vidaillet H, Broste S, Bellamy P, Lynn J and Knaus WA. The effectiveness of right heart catheterization in the initial care of critically ill patients. SUPPORT Investigators. Jama 276: 889-897., 1996.
6. Lavandier B, Cathignol D, Muchada R, Xuan BB and Motin J. Noninvasive aortic blood flow measurement using an intraesophageal probe. Ultrasound Med Biol 11: 451-460., 1985.
7. Lefrant JY, Bruelle P, Aya AG, Saissi G, Dauzat M, de La Coussaye JE and Eledjam JJ. Training is required to improve the reliability of esophageal Doppler to measure cardiac output in critically ill patients. Intensive Care Med 24: 347-352., 1998.
8. Cariou A, Monchi M, Joly LM, Bellenfant F, Claessens YE, Thebert D, Brunet F and Dhainaut JF. Noninvasive cardiac output monitoring by aortic blood flow determination: evaluation of the Sometec Dynemo-3000 system. Crit Care Med 26: 2066-2072., 1998.
9. Freund PR. Transesophageal Doppler scanning versus thermodilution during general anesthesia. An initial comparison of cardiac output techniques. Am J Surg 153: 490-494., 1987.
10. Kumar A, Minagoe S, Thangathurai D, Mikhail M, Novia D, Viljoen JF, Rahimtoola SH and Chandraratna PA. Noninvasive measurement of cardiac output during surgery using a new continuous-wave Doppler esophageal probe. Am J Cardiol 64: 793-798., 1989.
11. Singer M, Clarke J and Bennett ED. Continuous hemodynamic monitoring by esophageal Doppler. Crit Care Med 17: 447-452., 1989.
12. Valtier B, Cholley BP, Belot JP, de la Coussaye JE, Mateo J and Payen DM. Noninvasive monitoring of cardiac output in critically ill patients using transesophageal Doppler. Am J Respir Crit Care Med 158: 77-83., 1998.
13. Singer M, Allen MJ, Webb AR and Bennett ED. Effects of alterations in left ventricular filling, contractility, and systemic vascular resistance on the ascending aortic blood velocity waveform of normal subjects. Crit Care Med 19: 1138-1145., 1991.
14. Mythen MG and Webb AR. Perioperative plasma volume expansion reduces the incidence of gut mucosal hypoperfusion during cardiac surgery. Arch Surg 130: 423-429., 1995.
15. Sinclair S, James S and Singer M. Intraoperative intravascular volume optimisation and length of hospital stay after repair of proximal femoral fracture: randomised controlled trial. Bmj 315: 909-912., 1997.
16. Hausen B, Schafers HJ, Rohde R and Haverich A. Clinical evaluation of transtracheal Doppler for continuous cardiac output estimation. Anesth Analg 74: 800-804., 1992.
17. Perrino AC, Jr., O'Connor T and Luther M. Transtracheal Doppler cardiac output monitoring: comparison to thermodilution during noncardiac surgery. Anesth Analg 78: 1060-1066., 1994.
18. Dark PM, Delooz HH, Hillier V, Hanson J and Little RA. Monitoring the circulatory responses of shocked patients during fluid resuscitation in the emergency department. Intensive Care Med 26: 173-179., 2000.
19. Lefrant JY, Benbabaali M, Ripart J, Aya AG, Sassi G, Dauzat M, de La Coussaye JE and Eledjam JJ. CO assessment by suprasternal Doppler in critically ill patients: comparison with thermodilution. Intensive Care Med 26: 693-697., 2000.
20. Fuller HD. The validity of cardiac output measurement by thoracic impedance: a meta-analysis. Clin Invest Med 15: 103-112., 1992.
21. Appel PL, Kram HB, Mackabee J, Fleming AW and Shoemaker WC. Comparison of measurements of cardiac output by bioimpedance and thermodilution in severely ill surgical patients. Crit Care Med 14: 933-935., 1986.
22. Critchley LA, Calcroft RM, Tan PY, Kew J and Critchley JA. The effect of lung injury and excessive lung fluid, on impedance cardiac output measurements, in the critically ill. Intensive Care Med 26: 679-685., 2000.
23. Young JD and McQuillan P. Comparison of thoracic electrical bioimpedance and thermodilution for the measurement of cardiac index in patients with severe sepsis. Br J Anaesth 70: 58-62., 1993.
24. Hirschl MM, Kittler H, Woisetschlager C, Siostrzonek P, Staudinger T, Kofler J, Oschatz E, Bur A, Gwechenberger M and Laggner AN. Simultaneous comparison of thoracic bioimpedance and arterial pulse waveform-derived cardiac output with thermodilution measurement. Crit Care Med 28: 1798-1802., 2000.
25. Summers RL, Kolb JC, Woodward LH and Galli RL. Diagnostic uses for thoracic electrical bioimpedance in the emergency department: clinical case series. Eur J Emerg Med 6: 193-199., 1999.
26. Critchley LA, Leung DH and Short TG. Abdominal surgery alters the calibration of bioimpedance cardiac output measurement. Int J Clin Monit Comput 13: 1-8., 1996.
27. Gratz I, Kraidin J, Jacobi AG, deCastro NG, Spagna P and Larijani GE. Continuous noninvasive cardiac output as estimated from the pulse contour curve. J Clin Monit 8: 20-27., 1992.
28. Rodig G, Prasser C, Keyl C, Liebold A and Hobbhahn J. Continuous cardiac output measurement: pulse contour analysis vs thermodilution technique in cardiac surgical patients. Br J Anaesth 82: 525-530., 1999.
29. Goedje O, Hoeke K, Lichtwarck-Aschoff M, Faltchauser A, Lamm P and Reichart B. Continuous cardiac output by femoral arterial thermodilution calibrated pulse contour analysis: comparison with pulmonary arterial thermodilution. Crit Care Med 27: 2407-2412., 1999.
30. Sakka SG, Reinhart K and Meier-Hellmann A. Comparison of pulmonary artery and arterial thermodilution cardiac output in critically ill patients. Intensive Care Med 25: 843-846., 1999.
31. McLuckie A, Murdoch IA, Marsh MJ and Anderson D. A comparison of pulmonary and femoral artery thermodilution cardiac indices in paediatric intensive care patients. Acta Paediatr 85: 336-338., 1996.
32. English JB, Hodges MR, Sentker C, Johansen R and Stanley TH. Comparison of aortic pulse-wave contour analysis and thermodilution methods of measuring cardiac output during anesthesia in the dog. Anesthesiology 52: 56-61., 1980.
33. Lichtwarck-Aschoff M, Zeravik J and Pfeiffer UJ. Intrathoracic blood volume accurately reflects circulatory volume status in critically ill patients with mechanical ventilation. Intensive Care Med 18: 142-147, 1992.
34. McLean AS, Needham A, Stewart D and Parkin R. Estimation of cardiac output by noninvasive echocardiographic techniques in the critically ill subject. Anaesth Intensive Care 25: 250-254., 1997.
35. Darmon PL, Hillel Z, Mogtader A, Mindich B and Thys D. Cardiac output by transesophageal echocardiography using continuous- wave Doppler across the aortic valve. Anesthesiology 80: 796-805, 1994.
36. Perrino AC, Jr., Harris SN and Luther MA. Intraoperative determination of cardiac output using multiplane transesophageal echocardiography: a comparison to thermodilution. Anesthesiology 89: 350-357., 1998.
37. Savino JS, Troianos CA, Aukburg S, Weiss R and Reichek N. Measurement of pulmonary blood flow with transesophageal two- dimensional and Doppler echocardiography. Anesthesiology 75: 445-451., 1991.
38. Cheung AT, Savino JS, Weiss SJ, Aukburg SJ and Berlin JA. Echocardiographic and hemodynamic indexes of left ventricular preload in patients with normal and abnormal ventricular function. Anesthesiology 81: 376-387., 1994.
39. Hinder F, Poelaert JI, Schmidt C, Hoeft A, Mollhoff T, Loick HM and Van Aken H. Assessment of cardiovascular volume status by transoesophageal echocardiography and dye dilution during cardiac surgery. Eur J Anaesthesiol 15: 633-640., 1998.